Investigación en didáctica de la Química
MODELADO MOLECULAR PARA LA ENSEÑANZA DE CONCEPTOS ABSTRACTOS EN QUÍMICA GENERAL DEL NIVEL UNIVERSITARIO
Juan Pablo Sánchez1,2, Julia Bernik3, Paola Quaino1,2
1- Universidad Nacional del Litoral, Facultad de Ingeniería Química. Santa Fe, Argentina.
2- Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET), Instituto de Química Aplicada del Litoral (IQAL). Santa Fe, Argentina.
3- Universidad Nacional del Litoral, Facultad de Humanidades y Ciencias. Santa Fe, Argentina.
E-mail: jpsanchez@fiq.unl.edu.ar
Recibido: 27/08/2024. Aceptado: 29/11/2024.
Resumen. El modelado molecular es una herramienta ampliamente utilizada en el ámbito de la investigación en Química. Esta herramienta puede ser incorporada en el aula universitaria de Química para favorecer los procesos de aprendizaje de algunos conceptos abstractos en esta disciplina. En el presente trabajo se estudió el efecto de la implementación de una serie de software de modelado molecular para el dictado de clases prácticas de Química General en los temas de geometría molecular, orbitales y diagrama de energía de orbitales. En especial, se pudo observar una mejora en la comprensión de conceptos de estructura electrónica y orbitales.
Palabras clave. TIC, modelado molecular, Química, orbitales
Molecular modeling for the teaching of abstract concepts in university-level general chemistry
Abstract. Molecular modeling is a widely used tool in the field of Chemical research. This tool can be incorporated into the university Chemistry classroom to enhance the learning processes of certain abstract concepts in this discipline. This study examined the effect of implementing a series of molecular modeling software for teaching practical General Chemistry classes on topics such as molecular geometry, orbitals, and orbital energy diagrams. An improvement was observed in the comprehension of orbitals and electronic structure.
Keywords. ICT, molecular modeling, chemistry, orbitals
INTRODUCCIÓN
La Química siempre se ha constituido, al igual que la mayoría de las Ciencias Naturales, como una ciencia experimental, donde los fenómenos que se observan o miden en laboratorios son fundamentados y explicados mediante una gran diversidad de teorías y modelos. Estas explicaciones y justificaciones de los fenómenos naturales observables han evolucionado a través de la historia humana, principalmente con la teoría atómica y las subsecuentes mejoras sobre los diferentes modelos atómicos que han sido propuestos (Ebbing y Gammon, 2007).
La Química posee un fuerte vínculo con lo fenomenológico, observable y manipulable (asociado al mundo macroscópico), y lo invisible y diminuto (asociado al mundo submicroscópico). Es específicamente en este aspecto en el cual los estudiantes de Química, en todos los niveles de educación, evidencian dificultades a la hora de comprender la naturaleza de ésta ciencia. Este andamiaje conceptual, que requiere de la fuerte combinación de procesos lógicos y abstractos y que no son siempre trabajados en los niveles iniciales (primario y secundario), se torna prioritario en los niveles superiores (terciario y universitario), ya que es en estos niveles educativos en donde se busca generar profesionales con formación científica que puedan construir y reconstruir los conceptos fundacionales de la disciplina en todos los niveles (Jonhstone, 1991, 1997). En este sentido, Johnstone (1982) identificó tres niveles de representación interrelacionados en los que se puede enseñar la química: macroscópico, microscópico (o submicroscópico) y simbólico. Este esquema fue estudiado por numerosos autores (Gkitzia, Salta y Tzougraki, 2020; Taber, 2013; Talanquer, 2010). El nivel simbólico se puede pensar como un puente entre los niveles microscópico y macroscópico, siendo aquí donde entran en relevancia las nuevas Tecnologías de la Información y la Comunicación (TIC), ya que constituyen un instrumento potente para vehiculizar el lenguaje simbólico mediante representaciones gráficas, las cuales pueden ser en dos o tres dimensiones, animadas y/o interactivas.
En particular, existen temas en Química, en todos los niveles y en especial en el universitario, que siempre presentan una gran dificultad para los alumnos, siendo éstos sobre todo los relacionados con estructura electrónica y geometría molecular (Taber, 1997). Este tipo de conceptos constituyen pilares básicos para poder entender otros fenómenos que se elaboran a partir de éstos, sin embargo, presentan una complejidad debido a las características de la Física (Física Cuántica) subyacente y la Matemática que existe para explicarlo. Es por esto que es un desafío afrontar estos temas sin que se confundan conceptos en el proceso de transposición didáctica al tratarlos en un curso inicial de Química (Chevallard, 1985; Lamoureux y Ogilvie, 2021). Es así que las TIC nos brindan herramientas que colaboran en procesos de comprensión de conceptos abstractos por parte de los estudiantes, siempre y cuando se encuentren enmarcados en propuestas de enseñanza que propicien y prioricen dichos procesos. En tal sentido, es posible pensar en la inclusión genuina de estas herramientas, dispositivos y aplicaciones (Maggio, 2012; 2018), en especial para estudiantes de primer año de carreras de Ciencia y Tecnología, no solo con fines didácticos sino también como manera de ampliar los horizontes de las posibles herramientas disponibles como profesionales de la disciplina.
OBJETIVOS
En el presente trabajo se busca estudiar el impacto de la utilización de prácticas educativas en la que se utilizan TIC, en particular programas de modelado molecular, para la enseñanza de conceptos abstractos, como lo son geometría molecular y orbitales, en alumnos de Química General.
METODOLOGÍA
Para este estudio se propuso la implementación de una clase de trabajo práctico mediado por nuevas tecnologías, utilizando programas de modelado molecular para abordar los temas de orbitales y geometría molecular en la asignatura Química General, que se encuentra en primer año para las carreras de Licenciatura en Química, Profesorado en Química, Químico Analista y Licenciatura en Física. Para indagar y cuantificar sobre los conocimientos adquiridos durante la práctica se implementó una evaluación antes y después de la actividad propuesta.
Propuesta didáctica
El trabajo práctico propuesto consistió en la utilización de una serie de programas (implementados a través de páginas de internet) de modelado molecular. Al estar disponibles de manera online, permiten que sean utilizados en cualquier plataforma (computadora, celular o tablet).
Esta actividad práctica además tenía una guía de consignas abiertas en las que los alumnos debían utilizar los programas disponibles para responder las preguntas que se les realizaban e informar todo en un trabajo final.
Las preguntas que se realizaron en el trabajo práctico rondaban sobre tres ejes temáticos:
Simetría: donde se trabajan conceptos de geometría molecular y polaridad de moléculas; Orbitales: se trabajan representación de orbitales atómicos y orbitales moleculares; Diagrama de orbitales moleculares: trabajan otras representaciones como los diagramas de orbitales moleculares, que permiten entender cómo se ordenan los electrones en átomos y moléculas. Los recursos utilizados fueron tres y en la figura 1 se pueden encontrar algunos ejemplos ilustrativos que muestran qué se puede realizar con cada uno de ellos.
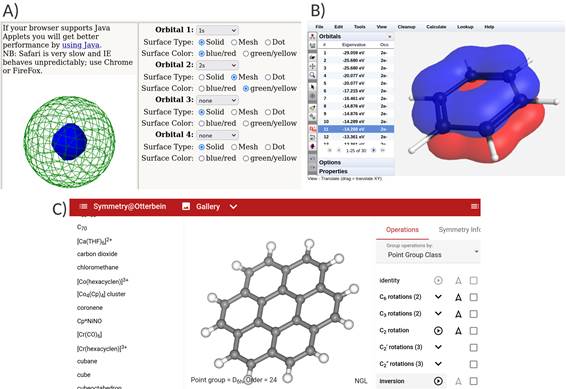
Figura 1. Capturas
de pantalla de los diferentes programas utilizados en las actividades
prácticas. A) Visor de orbitales atómicos (Gutow, s.f.). B) webMO, interfaz
para dibujado, visualización y optimización de geometría y orbitales de
moléculas (webMO, 2020). C) Galería de moléculas para visualizar su simetría
(Otterbein University, s.f.)
Las consignas solicitadas consistían en representar diferentes orbitales atómicos y orbitales moleculares de una serie de moléculas simples. Además, identificar los enlaces presentes, categorizar geometrías moleculares, encontrar elementos de simetría y relacionar la energía de los orbitales con diagramas de orbitales moleculares. Algunos ejemplos de las consignas son:
Ejemplo 1:
“En función de las moléculas vistas en la guía tutorial, buscá algunas que te resulten de interés (en internet, guías de problemas, etc). Elegí de entre ellas algunas donde se puedan ver claramente los siguientes elementos de simetría (puede ser una o varias moléculas): un eje de rotación propio; un plano de simetría; un punto de inversión. Graficala/s la molécula con ayuda de algunas de las herramientas de clase y sacá captura de pantalla(o foto). Detallá en el informe que elementos de simetría posee y si tendría momento dipolar o no. Además, determiná si se encuadra dentro de algunas de las geometrías dadas en clase”
Ejemplo 2:
“Elegí alguna molécula diatómica (homonuclear o heteronuclear) de interés (de internet, guías de problemas, etc)y utilizá el software webMO para graficar los orbitales moleculares, sacá captura de pantalla (o foto) para diferentes tipos de orbitales moleculares (al menos 3). Describí de qué tipo de orbital se trata (procurá buscar moléculas donde se puedan ver algunos orbitales que correspondan a alguna de estas categorías: σ, π, enlazante, antienlazante ).”
Ejemplo 3:
“El monóxido de carbono presenta algunas particularidades cuando uno plantea su estructura de Lewis. Para evitar dudas uno puede directamente representarlo utilizando orbitales moleculares. Para ello puede utilizar programas como los usados en clase. Utilizá algunos de los programas vistos para obtener sus orbitales. Compará luego con su estructura de Lewis ¿Cuántos enlaces tiene según la teoría de orbitales moleculares? ¿Y según Lewis? Identifica los orbitales según si son enlazantes, antienlazantes, no enlazante, σ ó π. ¿Podrías calcular el orden de enlace?”
Mediante esta propuesta se hizo interactuar a los alumnos con los modelos de manera tal que encuentren por su cuenta con qué representaciones se puede explicar mejor lo solicitado en las consignas del trabajo.
Recopilación de datos
Para evaluar la implementación del trabajo práctico y debido a que solo se cuenta con una comisión, se llevó a cabo un diseño cuasiexperimental de pretest y postest (Campbell, Cook y Shadish, 2001; Harris et al., 2006). Este diseño consiste en evaluar a los alumnos antes del trabajo práctico con los contenidos teóricos dados (pretest) para luego evaluarlos al finalizar el trabajo práctico (postest). En ambas instancias las preguntas eran idénticas. Las preguntas realizadas se encontraban relacionadas con los ejes temáticos ya mencionados: simetría, orbitales y diagrama de orbitales. Algunos ejemplos de las preguntas realizadas se encuentran en la figura 2.
La primera implementación del trabajo práctico se llevó a cabo durante el primer cuatrimestre de 2020, por lo que estuvo afectado por el Aislamiento Social, Preventivo y Obligatorio (ASPO) en el contexto de la pandemia de COVID-19. Al tratarse de herramientas online y el uso de computadoras, la realización de la actividad logró incluirse de una manera orgánica en el cursado virtual.
En esta oportunidad, se mostrarán resultados del primer cuatrimestre de 2020, obtenidos durante el período de ASPO, y del primer cuatrimestre de 2024, donde ya se contaba con total presencialidad en las clases. De esta manera, se pudieron evaluar posibles diferencias en la implementación del trabajo práctico.
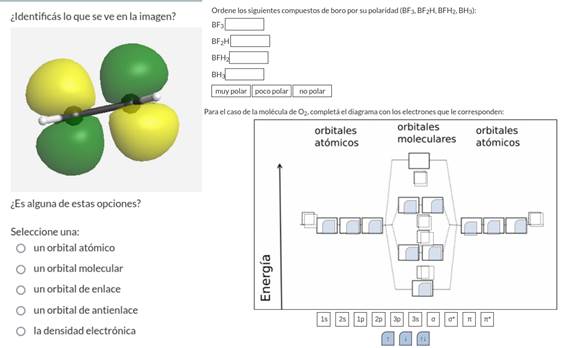
Figura 2.
Algunos ejemplos de preguntas realizadas en los cuestionarios pretest/postest.
RESULTADOS Y DISCUSIÓN
Para el análisis de los resultados del diseño pretest/postest, se evaluaron los puntajes de los estudiantes por cada categoría trabajada (simetría, orbitales y diagrama de orbitales), donde se puede ver un ejemplo de cada categoría en la figura 2. El puntaje para cada categoría tiene un rango que varía entre 0 y 1, siendo 0 el puntaje mínimo y 1 el puntaje máximo. Con esto se construyeron los histogramas que dan lugar a la distribución de puntajes por categorías que se pueden ver en las figuras 3, 4 y 5. Estos histogramas permiten establecer de manera accesible los cambios en las calificaciones por categoría para los estudiantes.
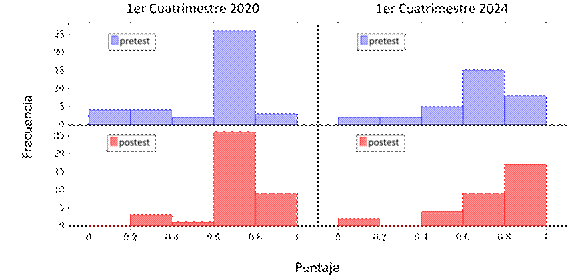 Figura 3.
Distribución de puntajes pretest y postest para la categoría “Simetría” en los
cuatrimestres estudiados.
Figura 3.
Distribución de puntajes pretest y postest para la categoría “Simetría” en los
cuatrimestres estudiados.
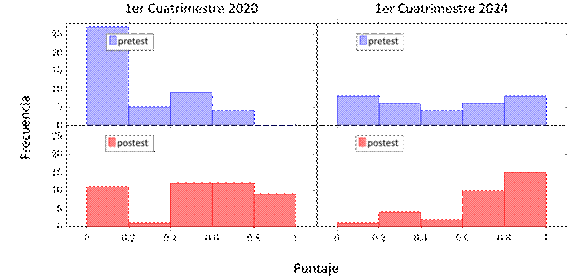 Figura 4.
Distribución de puntajes pretest y postest para la categoría “Orbitales” en los
cuatrimestres estudiados.
Figura 4.
Distribución de puntajes pretest y postest para la categoría “Orbitales” en los
cuatrimestres estudiados.
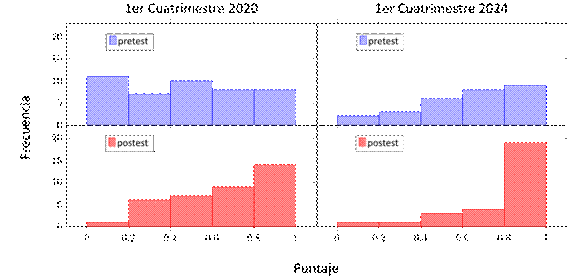 Figura 5.
Distribución de puntajes pretest y postest para la categoría “Diagrama de
orbitales” en los cuatrimestres estudiados.
Figura 5.
Distribución de puntajes pretest y postest para la categoría “Diagrama de
orbitales” en los cuatrimestres estudiados.
Respecto a la categoría de simetría, se puede ver en la figura 3 su distribución de puntajes antes y después. Se partió en ambos años estudiados de una distribución con puntajes bastante altos con la gran mayoría teniendo un puntaje entre 0,6 y 0,8. Luego en el postest se observa que no existió un cambio significativo ya que se detecta la misma tendencia. Se encontró una leve mejora en el general de las calificaciones lo que es un resultado esperable en este tipo de estudios en los cuales los alumnos se encuentran con la misma instancia de evaluación.
En la categoría de orbitales, las preguntas estaban orientadas particularmente a la identificación de diferentes tipos de orbitales, observándose en la figura 4 que los puntajes del pretest fueron bajos (2020) o muy heterogéneos (2024). Luego de la realización del trabajo práctico y su evaluación via el postest, nuestros resultados muestran una mejora en las puntuaciones en ambos casos.
Finalmente, la figura 5 muestra las distribuciones de puntajes correspondientes a la categoría diagrama de orbitales, en la cual se evaluó principalmente el llenado de distintos tipos de configuraciones electrónicas (en particular de moléculas diatómicas). Se observa un comportamiento similar al caso previamente descripto de orbitales moleculares, donde las calificaciones iniciales se encontraron en un rango bajo o ampliamente distribuidas, mientras que luego del trabajo práctico, los resultados del postest exhibieron una mejora apreciable.
CONCLUSIONES
La implementación de trabajos prácticos mediados con nuevas tecnologías, en particular el uso de herramientas de modelado molecular, permitió trabajar conceptos abstractos como lo son los orbitales atómicos y moleculares en el aula. A su vez, la posibilidad de interactuar con el modelo dinámicamente habilitaba a los estudiantes a probar y jugar con las actividades y herramientas propuestas. Es por esto que la propuesta tuvo buena recepción por parte de los estudiantes, no solo como actividad en sí, sino también como herramienta para el estudio de la asignatura.
En relación a los resultados, la identificación de orbitales y el diagrama de orbitales fueron los temas que tuvieron mayor mejora en los puntajes postest. Este tipo de mejora se observa en otros trabajos similares (Ruddick, Parrill y Petersen, 2012; Li et al., 2024), donde se detecta un avance en la identificación e interpretación de orbitales y configuración electrónica mediante la utilización de herramientas computacionales tales como software de modelado u otras herramientas interactivas. En otras palabras, un primer acercamiento con un modelo 3D y a la nomenclatura específica para orbitales (atómicos y moleculares) permitiría los alumnos familiarizarse mucho más rápidamente con estos conceptos abstractos.
Por su parte, la idea de geometría no mostró una mejora sustancial respecto a lo ya trabajado en clase. De todos modos, el modelado para las representaciones geométricas se mantiene como una vía más versátil que el pizarrón o un libro de texto, debido a que permite la rotación, traslación y modificación del sistema en estudio, así como también animación. El trabajo con modelos 3D para enseñar geometría se ha trabajado (Marchak, Shvarts-Serebro y Blonder, 2021; Levy et al., 2024) previamente y demuestran que para un aprendizaje o familiarización más profunda con las geometrías moleculares es necesario mayor interacción con el modelo. En este sentido, como avance para esta dimensión se propone plantear actividades focalizadas en la geometría y la simetría con la incorporación de la construcción de una variedad de moléculas y su posterior análisis y comparación.
En base a los resultados obtenidos, resultaría interesante, además de cuantificar las respuestas, estudiar los informes elaborados por los estudiantes para evaluar la calidad de sus respuestas, en especial respecto a los temas de simetría y diagrama de orbitales.
Por otro lado, luego del análisis de las respuestas de los alumnos para los años 2020 y 2024, se observó que las tendencias entre categorías presentaron similitudes, por lo que no se detectó un efecto notable debido al contexto de educación virtual durante el ASPO. Dado que las condiciones de evaluación fueron similares durante y posterior a la pandemia, esto indicaría la potencialidad de este tipo de herramientas para actividades tanto sincrónicas y presenciales como virtuales y asincrónicas.
REFERENCIAS BIBLIOGRÁFICAS
Campbell, D. T., Cook, T. D. y Shadish, W. R., Jr. (2001). Experimental and quasi-experimental designs for generalized causal inference. Houghton Mifflin.
Chevallard, Y. (1985). La transposition didactique. Du savoir savant au savoir enseigné. Grenoble: La Pensee Sauvage.
Ebbing, D. y Gammon, S. (2007). General Chemistry (9th Ed.). Brooks Cole.
Gkitzia, V., Salta, K. y Tzougraki, C. (2020). Students’ competence in translating between different types of chemical representations. Chemistry Education Research and Practice, 21(1), 307-330. https://doi.org/10.1039/C8RP00301G
Gutow, J. (s.f.). Dr. Gutow’s Atomic Orbital Viewer. https://cms.gutow.uwosh.edu/gutow/Orbitals/Cl/Cl_AOs.shtml
Harris, A. D., McGregor, J. C., Perencevich, E. N., Furuno, J. P., Zhu, J., Peterson, D. E. y Finkelstein, J. (2006). The use and interpretation of quasi-experimental studies in medical informatics. Journal of the American Medical Informatics Association: JAMIA, 13(1), 16–23. https://doi.org/10.1197/jamia.M1749
Johnstone, A. H. (1982). Macro- and microchemistry. School Science Review, 64, 377–379.
Johnstone, A. H. (1991). Why is science difficult to learn? Things are seldom what they seem. Journal of Computer Assisted Learning, 7(2), 75–83.
Johnstone, A. H. (1997). Chemistry Teaching - Science or Alchemy? 1996 Brasted Lecture. Journal of Chemical Education, 74(3), 262.
Lamoureux, G. y Ogilvie, J. F. (2021). Orbitals in general chemistry, part I: the great debate. Química Nova, 44(2), 224–228. https://doi.org/10.21577/0100-4042.20170649
Levy, J., Chagunda, I. C., Iosub, V., Leitch, D. C. y McIndoe, J. S. (2024). MoleculAR: An augmented reality application for understanding 3D geometry. Journal of Chemical Education, 101(6), 2533–2539. https://doi.org/10.1021/acs.jchemed.3c01045
Li, X., Muñiz, M., Chun, K., Tai, J., Guerra, F. y York, D. M. (2022). Online Orbital Explorer and BingOrbital Game for inquiry-based activities. Journal of Chemical Education, 99(5), 2135–2142. https://doi.org/10.1021/acs.jchemed.1c01277
Maggio, M. (2018). Reinventar la clase en la universidad. Paidós.
Maggio, M. (2012). La enseñanza re-concebida: La hora de la tecnología. Nuevas tendencias culturales y su aplicación en las propuestas didácticas. Aprender para e-ducar con tecnologías, 1, 4-8. http://www.inspt.utn.edu.ar/pdf/aprender_para_educar.pdf
Marchak, D., Shvarts-Serebro, I. y Blonder, R. (2021). Crafting molecular geometries: Implications of neuro-pedagogy for teaching chemical content. Journal of Chemical Education, 98(4), 1321–1327. https://doi.org/10.1021/acs.jchemed.0c00306
Otterbein University (s.f.) Symmetry Resources at Otterbein University. https://symotter.org/
Ruddick, K. R., Parrill, A. L. y Petersen, R. L. (2012). Introductory molecular orbital theory: An honors general chemistry computational lab as implemented using three-dimensional modeling software. Journal of Chemical Education, 89(11), 1358–1363. https://doi.org/10.1021/ed2003719
Taber, K. S. (1997). Understanding chemical bonding: The development of A-level students’ understanding of the concept of chemical bonding [Tesis de doctorado, University of Surrey]. University of Surrey Open Research. https://openresearch.surrey.ac.uk/esploro/outputs/doctoral/Understanding-Chemical-Bonding-The-Development-of/99513707902346#file-0
Taber, K. S. (2013). Revisiting the chemistry triplet: Drawing upon the nature of chemical knowledge and the psychology of learning to inform chemistry education. Chemistry Education Research and Practice, 14(2), 156-168. https://doi.org/10.1039/C3RP00012E
Talanquer, V. (2010). Macro, Submicro, and Symbolic: The many faces of the chemistry “triplet”. International Journal of Science Education, 33(2), 179–195. https://doi.org/10.1080/09500690903386435
webMO. (2020). webMO a web-based interface to computational Chemistry packages. https://www.webmo.net/