Innovación para la enseñanza de la Química
DETERMINACIÓN DE CO2 EN UN DISEÑO EXPERIMENTAL. INTEGRACIÓN DE BIOLOGÍA Y QUÍMICA EN LA UNIVERSIDAD
Andrés Raviolo
Universidad Nacional de Río Negro. Laboratorio de Investigación en Didáctica de las Ciencias (LIDCIN). Bariloche.
Email: araviolo@unrn.edu.ar
Recibido: 24/08/2022. Aceptado: 09/01/2023.
Resumen. Se presentan los resultados de una experiencia didáctica llevada adelante por estudiantes de Química General de primer año de Licenciatura en Biología. En esta actividad se les solicita que analicen un artículo educativo que presenta un diseño experimental para la determinación de dióxido de carbono producido por muestras biológicas. Las y los estudiantes profundizan en los conceptos y procedimientos químicos involucrados en esta práctica de laboratorio de Biología General, aplicando lo aprendido en química. El objetivo es reflexionar sobre la integración entre ambas asignaturas; y en particular, sobre los aspectos comunes de las ciencias experimentales que deberían abordarse en forma conjunta con los mismos criterios y terminología. Se realiza un análisis cualitativo de los resultados obtenidos, en la que se discuten aspectos conceptuales y pedagógicos. Se rescata el valor de esta actividad, que puede ser planteada tanto por profesores de química como de biología, para consolidar aprendizajes. Se insta a mejorar la comunicación y búsqueda de acuerdos entre docentes de las distintas disciplinas.
Palabras claves. determinación de CO2, biología, química, integración.
Determination of CO2 in an experimental design. Integration of Biology and Chemistry in the University
Abstract. The results of a didactic experience carried out by General Chemistry students of the first year of the Bachelor's Degree in Biology are presented. In this activity they are asked to analyze an educational article that presents an experimental design for the determination of carbon dioxide produced by biological samples. The students delve into the chemical concepts and procedures involved in this General Biology laboratory practice, applying what they have learned in chemistry. The objective is to reflect on the integration between both subjects; and in particular, on the common aspects of the experimental sciences that should be addressed jointly with the same criteria and terminology. A qualitative analysis of the results obtained is carried out, in which conceptual and pedagogical aspects are discussed. The value of this activity is rescued, which can be raised by both chemistry and biology teachers, to consolidate learning. It is urged to improve communication and search for agreements between teachers of different disciplines.
Key words. determination of CO2, biology, chemistry, integration.
INTRODUCCIÓN
En primer año de una carrera de ciencias naturales, como es el caso de una Licenciatura en Biología, las y los estudiantes cursan en simultáneo materias de Biología, Química, Matemática e incluso Física. La articulación horizontal entre asignaturas del mismo año, tanto de nivel secundario como de universidad, es una acción deseable si está orientada a consolidar los aprendizajes de cada asignatura y a brindar una imagen unificadora de las ciencias experimentales.
En muchas ocasiones los mismos conceptos y procedimientos se abordan en las distintas disciplinas con diferencias de terminología y de enfoques, lo cual no promueve el aprendizaje significativo, que implica el establecimiento de relaciones del nuevo material con el conocimiento previo existente en la memoria de largo plazo. En particular, lo anterior es especialmente relevante en lo referido a la medición. A los contenidos conceptuales, procedimentales y actitudinales relacionados a la medición; por ejemplo, el concepto de medida, errores de apreciación de los instrumentos, la selección adecuada de instrumentos, la expresión correcta de las medidas que trasluzcan el instrumento usado, el empleo de cifras significativas, el manejo de las mismas, las actitudes de persistencia y duda.
Izquierdo (2022) menciona que los programas de Biología y de Química muestran en su conjunto muchos desajustes, pero fundamentalmente la pérdida de una ocasión para tender puentes entre ambas disciplinas y, de esta manera, optimizar los recursos que disponemos para iniciar a las y los estudiantes en el conocimiento científico.
El artículo de Tognetti (2009) describe la experiencia didáctica realizada como trabajo práctico sobre respiración celular, llevado a cabo en la asignatura Biología General. En esta experiencia cada grupo de estudiantes formula preguntas del tipo: ¿las semillas secas tienen la misma capacidad respiratoria que las húmedas?, ¿en una porción de suelo quemado hay menos actividad respiratoria que en una de suelo sin quemar?, ¿respiran más las babosas que las lombrices? Formulan hipótesis y llevan adelante el diseño experimental, que muestra la Figura 1, para cotejarlas. En ese experimento se compara, para cada tratamiento, la cantidad de dióxido de carbono atrapado por una disolución de hidróxido de sodio. El resultado final se expresa en mg de CO2 por gramo de biomasa.
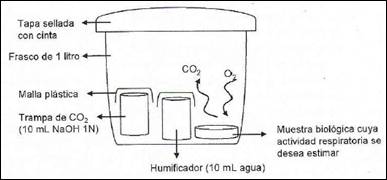
Figura 1. Diseño experimental para determinación de la actividad respiratoria (Tognetti, 2009).
En este diseño se ponen en juego los siguientes conceptos químicos: disoluciones, concentraciones, gases, reacciones químicas, reacciones ácido base, de precipitación y de óxido reducción, reactivo limitante y en exceso, estequiometría, estequiometría con disoluciones, titulaciones.
En este artículo se discuten los resultados de una experiencia llevada adelante por estudiantes de Química General, en la que se les solicita que analicen el artículo de Tognetti con la intención de que apliquen y consoliden conceptos y procedimientos abordados en instancias teóricas y prácticas (problemas y laboratorios) de química. Las discusiones y conclusiones se orientan a resaltar el rol de los conceptos básicos de las ciencias experimentales y, en especial, de la medición, en una enseñanza y aprendizaje de las ciencias naturales en forma integrada.
CONTEXTO
En esta experiencia participaron estudiantes que cursaron la asignatura Química General 1, de la carrera de Licenciatura en Ciencias Biológicas en el Centro Regional Universitario Bariloche, de la U. N. del Comahue. Esta materia del primer cuatrimestre se cursa simultáneamente a la asignatura cuatrimestral Biología General.
La materia Química General 1, responde a un programa que sigue una secuencia lógica de contenidos de química general de libro de texto. Esta cátedra se guía por Química de Chang, y aborda los 9 primeros capítulos.
Esta actividad de integración se lleva a cabo luego que completaron la unidad 4 de disoluciones y reacciones químicas y la unidad 5 de gases. Las y los estudiantes acudieron a clases teóricas, a clases de resolución de problemas (por ejemplo de estequiometría con disoluciones y con gases) y a dos prácticos de laboratorio. En el primer laboratorio reconocieron materiales de vidrio, realizaron medidas de masas y de volúmenes y prepararon disoluciones (en unidades de concentración M, % m/V y % m/m) a partir de soluto sólido. Se hizo hincapié en los errores de apreciación de los instrumentos y en la expresión correcta de las medidas. En el segundo práctico prepararon disoluciones a partir de otras más concentradas y realizaron dos titulaciones. Titularon una disolución de ácido clorhídrico (de 0,10 M aprox.) con una disolución de carbonato de sodio (0,100 M). El carbonato de sodio previamente secado se considera como patrón primario. Posteriormente, una vez calculada la concentración de HCl con los datos de la titulación, titularon con ese HCl una disolución preparada de NaOH (de 0,10 M aprox.). También fueron evaluados sobre estos temas en un examen parcial.
Este grupo de estudiantes, de la cursada 2022, no realizaron en la asignatura de Biología General este práctico de laboratorio de determinación de dióxido de carbono. En los años anteriores a la pandemia se implementó en dicha asignatura este trabajo práctico. En los años anteriores desde la asignatura de Química General se abordó este diseño, en forma expositiva, y como ejemplo de aplicación de los conceptos químicos vistos.
OBJETIVOS
Los objetivos de este artículo son:
- Compartir los resultados y reflexiones de una experiencia llevada adelante por estudiantes de Química General, en la que se les solicita que analicen un artículo educativo que presenta un diseño experimental para la determinación de dióxido de carbono producido por muestras biológicas. Se pretende que las y los estudiantes indaguen y profundicen en los conceptos y procedimientos químicos involucrados en esta práctica de laboratorio de biología, aplicando y consolidando lo aprendido en química.
- Reflexionar sobre la integración entre ambas asignaturas; y en particular, sobre los aspectos comunes de las ciencias experimentales que deberían abordarse en forma conjunta con los mismos criterios y terminología.
METODOLOGÍA
Inicialmente se revisó en profundidad el artículo de Tognetti (2009) analizando los conceptos y procedimientos químicos que aparecían, su adecuación conceptual y la forma en que se expresaban; así también como, su abordaje comparándolo con los enfoques vivenciados por las y los estudiantes en Química General. Sobre la base de ese análisis se construyó una guía con 17 preguntas y/o actividades (Tabla 1), para orientar a las y los estudiantes en este trabajo de integración.
Finalmente, se les solicitó una apreciación de la actividad llevada a cabo, a través de las siguientes preguntas: ¿Te gustó esta actividad de integración? ¿Pudiste vincular y/o aplicar los conceptos vistos en la teoría y práctica de Química General? ¿Te resultó una actividad difícil? ¿Te pareció una actividad útil? Expresa, si deseas, algún otro comentario.
Esta experiencia didáctica en química se enmarca en un enfoque constructivista por ser un marco teórico útil para una investigación que busca comprender la construcción del conocimiento, las concepciones alternativas y la evolución conceptual en el tiempo (Bodner y Orgill, 2007). El marco teórico, en el contexto de una investigación educativa, orienta las preguntas de investigación, los métodos de recolección y análisis de los datos. La indagación se realiza en un curso real, con las complejidades propias de la práctica áulica, por lo que la literatura recomienda el empleo de métodos cualitativos para analizar las intervenciones planificadas (Prediger et al., 2015). Por tratarse de una experiencia en un contexto educativo no es deseable simplificar los resultados a través de tendencias numéricas u orientar las discusiones a un molde rígido de certezas; por ello, se adopta un enfoque cualitativo para inspirar en pares conclusiones y reflexiones más profundas (Silverman, 2000).
Participaron 27 estudiantes de la asignatura Química General 1. En algunos casos se devolvieron a las y los estudiantes las guías resueltas, con algunas indicaciones para que fueran revisadas y/o ampliadas. A continuación, se presenta un análisis cualitativo de los resultados obtenidos, dado que no interesa el porcentaje de estudiantes que contestó bien cada pregunta, sino las reflexiones de tipo conceptual y pedagógico que se desprenden de esta experiencia. El foco está en rescatar los aspectos que pueden resultar de interés para docentes de química o de biología que deseen replicar este diseño experimental de gran potencia para el aprendizaje.
Tabla 1: Guía de preguntas y actividades.
Trabajo de integración entre Biología y Química. Determinación de dióxido de carbono en una experiencia de respiración celular.
1- Lectura del artículo: “Uso de una técnica sencilla de determinación de CO2 en primer año de la carrera universitaria de biología” de Celia Tognetti, publicado en la Revista de Educación en Biología, 2009, 12(2), 22-26. Se adjunta.
2- ¿Cuáles son los objetivos que persigue el práctico de laboratorio presentado?
3- ¿Cómo caracteriza la autora al método científico seguido?
4- ¿En qué unidades se presentan las concentraciones de las disoluciones? Explicar la diferencia entre M y N. ¿Hay diferencias en los valores de M y N para las disoluciones empleadas en la experiencia?
5- ¿Qué crítica harías a la forma en cómo se expresan en el artículo las medidas de volúmenes y concentraciones?
6- ¿Qué materiales e instrumentos de medición del laboratorio se utilizarían? Expresa los materiales, capacidades y errores de apreciación.
7- Teniendo en cuenta tu experiencia en titulaciones en el laboratorio de química, ¿qué práctica experimental llevarías a cabo antes de realizar la titulación que menciona el artículo?
8- ¿Para qué se agrega cloruro de bario? ¿Qué pasaría si no se lo agrega? Escribe la ecuación química en la que participa el cloruro de bario.
9- Escribir todas las ecuaciones químicas de las reacciones que están involucradas en la experiencia y clasifícalas de cuerdo a: reacciones de ácido-base, de precipitación, de óxido-reducción.
10- ¿Para qué sirve el blanco? ¿Qué porcentaje de dióxido de carbono hay en el aire? Teniendo en cuenta las preguntas de investigación que aparecen en la Tabla 2 del artículo: ¿Es necesario realizar el blanco?
11- ¿Qué pasaría si el tratamiento incluye plantas expuestas a la luz?
12- ¿En qué unidades se expresa el resultado final de la experiencia?
13- ¿Cuántos moles de NaOH se tienen inicialmente en el recipiente trampa de dióxido de carbono? Concentración de NaOH(ac): 1,00 M. Expresar los planteos (Respuesta: 1,00 x10-2 moles)
14- Con los siguientes datos, a modo de ejemplo, calcula los miligramos de dióxido de carbono por gramo de biomasa. Volumen gastado de HCl 0,500 M en la titulación: 11,2 mL; Masa de biomasa: 3,50 g. Expresar todos los planteos. (Respuesta: 27,7 mg/g)
15- ¿Qué porcentaje del hidróxido de sodio inicial se consumió al reaccionar con el dióxido de carbono producido por respiración de la biomasa? (Respuesta: 44,0 %)
16- Teniendo en cuenta los datos anteriores ¿qué volumen mínimo de disolución de BaCl2 0,750 M se debería agregar estequiometricamente? Expresar los planteos (Respuesta: 2,93 mL)
17- Puedes agregar alguna observación o comentario sobre el diseño experimental o sobre aspectos químicos y biológicos.
RESULTADOS
La primera actividad consistía en leer el artículo (Tognetti, 2009) y la segunda responder sobre cuáles son los objetivos que persigue el práctico de laboratorio presentado en ese artículo. Estos objetivos se encuentran enumerados en el artículo y, en general, fueron transcriptos por las y los estudiantes. Los objetivos son: (a) evidenciar la actividad respiratoria de diferentes organismos en diversas condiciones ambientales, (b) ejercitarse en el uso del método científico y (c) relacionar distintos conceptos y procesos biológicos que estudiaron en la asignatura de Biología General.
En los objetivos se omite relacionar también con los conceptos y procesos que estudiaron en la asignatura Química General. Una actitud científica deseada es ser crítico sobre la adecuación de lo que se hace, de las técnicas empleadas, incluyendo las técnicas químicas. Se trata de asumir conceptos, actitudes y procedimientos básicos de las ciencias experimentales de una forma integrada.
En la pregunta 3, se indaga sobre la caracterización que alude la autora sobre el método científico. Interesan las respuestas que van más allá de copias textuales extraídas del texto, entre ellas: “Un conjunto de tácticas empleadas para construir conocimiento”, “El método seguido es el hipotético deductivo, en el cual se formula una interrogante y se crean hipótesis y predicciones acordes a la explicación que se busca, para luego apoyarlas o rechazarlas mediante las conclusiones que se alcanzaron en base a ciertos experimentos.”
Desde la actividad 4 en adelante se orienta a que las y los estudiantes reconozcan y apliquen conceptos y procedimientos químicos previamente abordados. La pregunta 4 indaga sobre las unidades de concentración de las disoluciones que se presentan en el artículo, dado que emplea molaridad y normalidad. Resulta innecesario el uso de normalidad, porque no se aborda en el curso de Química General y le aporta una dificultad extra al diseño. Además no hay diferencias en los valores entre M y N para disoluciones usadas (NaOH y HCl). Esto es expresado por un estudiante: “No hay diferencia de concentración en las disoluciones con valores de M y N.”
La falta de integración con la química se pone de manifiesto en la forma en que se expresan las medidas de volúmenes y concentraciones en el artículo. La pregunta 5 se refiere a este aspecto. La mayoría del alumnado, identificó esta inadecuación, de no tener en cuenta el tema de los errores de apreciación de los instrumentos. En el artículo se expresan volúmenes “10 mL” y concentraciones “1 N”, “0,5 N”. La expresión de las medidas fue un tema muy trabajado en todo el cuatrimestre en Química General y aplicado en todas las clases y guías de ejercicios y laboratorios. Al respecto, mencionan: “No están anotadas con la precisión correspondiente, por lo que se puede confundir con qué elemento se deben medir. Por ejemplo: “10 mL”, esto se debería anotar como 10,0 mL ya que de esta manera te indica que hay utilizar una pipeta graduada de 10,0 mL con un error de apreciación de +-0,1 mL”, “Cuando se titulan 10 mL, no se sabe con qué instrumento se midió; pudo ser una pipeta volumétrica o una pipeta graduada.”
El objetivo de la pregunta 6 es que agreguen los materiales de laboratorio necesarios para realizar las titulaciones. La mayoría mencionó bureta, erlenmeyer y pipeta volumétrica. Los cálculos de una titulación se comprenden mejor si se visualiza la situación experimental y se realiza una representación o esquema durante la resolución.
En el diseño experimental propuesto en el artículo se introduce en un recipiente “10 mL” de una disolución “1N” de NaOH y luego se titula la cantidad de NaOH remanente con una disolución de HCl “0,5 N”. Al respecto, en la actividad 7 se pregunta: “Teniendo en cuenta tu experiencia en titulaciones en el laboratorio de química, ¿qué práctica experimental llevarías a cabo antes de realizar la titulación que menciona el artículo?” Esta pregunta apunta a que las y los estudiantes apliquen lo aprendido en el práctico sobre titulaciones realizado en Química General. Hagan mención a que las disoluciones de hidróxido de sodio y de ácido clorhídrico no son estables, no son solutos confiables al no ser patrones primarios, y la necesidad de valorarlos previamente. Entre las respuestas se destacan: “Antes de hacer la titulación que menciona el artículo, para asegurarse de que el HCl tiene la concentración que indica su rotulo, (ya que esta disolución es bastante volátil) primero se debería titular el HCl con una base de concentración conocida.”
En la técnica expresada en el artículo se menciona que, antes de titular con HCl, al NaOH remanente al finalizar la experiencia se le debe agregar “10 mL” de disolución de cloruro de bario “0,75 M”, pero no se indica el por qué se realiza este agregado. La pregunta 8 aborda esta cuestión. Dado que el dióxido de carbono capturado genera carbonato de sodio y, por lo tanto, en el recipiente a titular con HCl habrá carbonato de sodio e hidróxido de sodio, la pregunta está orientada a que las y los estudiantes reconozcan que ambos solutos reaccionan con el HCl, como lo comprobaron en el práctico de titulaciones realizado en Química General. De allí la necesidad de precipitar el carbonato con cloruro de bario, generando carbonato de bario insoluble. Este tema es conocido por las y los estudiantes dado que se estudiaron las reacciones de precipitación, se ejercitó en el uso de la tabla de solubilidades y se experimentó con la reacción entre cloruro de sodio y nitrato de plata. Expresaron: “El cloruro de bario se agrega para que reaccione con el carbonato de sodio y se genere una precipitación. Y de esa manera poder titular correctamente el hidróxido de sodio. Si no se agregaría no se podría titular de manera precisa, ya que ambas soluciones de carbonato de sodio e hidróxido de sodio reaccionarían con el HCl.”
Uno de los temas trabajado en profundidad en el curso de química fue la clasificación de las reacciones químicas en reacciones de ácido-base, de precipitación, y de óxido-reducción. En la actividad 9 se solicita que escriban todas las ecuaciones químicas de las reacciones que están involucradas en el artículo y las clasifiquen, dado que aparecen ejemplos de los tres tipos de reacciones: reacción entre el HCl y NaOH (ácido-base), reacción entre el Na2CO3 y BaCl2 (precipitación) y la reacción de combustión de la glucosa o reacción general de la respiración (óxido-reducción). La mayoría pudo contestar bien esta actividad, aunque pocos se percataron que la ecuación del proceso completo de respiración celular expresada en el artículo está mal ajustada, dado a que no aparece el coeficiente estequiométrico del O2 (6O2) y transcribieron esa ecuación manteniendo el error.
En el diseño experimental propuesto en esta experiencia de biología, se pide realizar un blanco, es decir una situación experimental idéntica a los tratamientos pero sin la muestra biológica, sin que se aclare cuál es el objetivo de esta iniciativa. Se trata, de medir el dióxido de carbono presente en el aire en ese volumen cerrado. Por ello la actividad 10 indaga: ¿Para qué sirve el blanco? ¿Qué porcentaje de dióxido de carbono hay en el aire? Teniendo en cuenta las preguntas de investigación que aparecen en la Tabla 2 del artículo: ¿Es necesario realizar el blanco? El hecho de que en la pregunta se hace referencia a la cantidad de CO2 del aire, varios estudiantes arribaron a respuestas correctas, aunque pocas respuestas percibieron que no es necesario si se pretenden realizar comparaciones como las expresada en la Tabla 2 del artículo, por ejemplo: “la producción de CO2 por unidad de biomasa es mayor para babosas que para lombrices”. En las respuestas de las y los estudiantes se destaca: “El porcentaje de CO2 en el aire es del 0,04% (400 partes por millón). Teniendo en cuenta las preguntas de investigación de la tabla 2, se puede concluir que el blanco no era necesario.”
La mayoría no tuvo inconvenientes en contestar bien la pregunta 11 sobre qué pasaría si el tratamiento incluye plantas expuestas a la luz, dado que la fotosíntesis es un concepto básico de biología. Una respuesta fue: “Si el experimento incluyera plantas expuestas a la luz, resultaría en una disminución de CO2 por unidad de biomasa debido al proceso de fotosíntesis, que recaptura parte del CO2 liberado por la respiración.”
La pregunta 12 apunta a identificar la unidad en que se expresa el resultado final del experimento para cada tratamiento. Las y los estudiantes no tuvieron dificultades en reconocer esta unidad, dado que la misma figura en el artículo y también en la guía de preguntas (pregunta 14). Su interés es llamar la atención que hay que referir los mg de CO2 producidos por gramo de biomasa incluida en cada tratamiento.
Consideramos que para realizar los cálculos las y los estudiantes tienen que tener presente la situación concreta experimental. En este caso, el hecho de que parten de 10,0 mL, 1,00 M, de NaOH. Por ello la pregunta 13 los invita a calcular cuántos moles de NaOH se tienen inicialmente en el recipiente trampa de dióxido de carbono, cuya respuesta es 1,00 x10-2 moles.
Con datos ficticios, se les propone en la pregunta 14, que calculen los miligramos de dióxido de carbono por gramo de biomasa, si el volumen gastado de HCl 0,500 M en la titulación fue 11,2 mL y la masa de biomasa: 3,50 g. Cuya respuesta es 27,7 mg/g. Al figurar la respuesta del problema, la mayoría arriba al resultado. Algunos con rodeos, como por ejemplo, pasando reiteradamente moles a gramos, algo que resulta innecesario en este ejemplo. Este tipo de resolución mecánica se observa frecuentemente en la resolución de ejercicios durante la cursada. En otros casos, cometieron el error de no restar a los moles iniciales de NaOH los moles de NaOH titulados o remanentes, para determinar la cantidad de NaOH que reaccionó con el dióxido.
La pregunta 15 les solicita que calculen el porcentaje del hidróxido de sodio inicial que se consumió al reaccionar con el dióxido de carbono producido por respiración de la biomasa. La mayoría de las y los estudiantes arribaron a la respuesta correcta (el 44,0 %) dado que inicialmente se tenía 1,00 x 10-2 moles y al final 5,60 x 10-3 moles.
Contribuyendo a fomentar actitudes científicas, como las de duda y revisión sobre lo actuado, en la pregunta 16 se plantea si la cantidad de cloruro de bario agregado es suficiente para precipitar todo el carbonato de sodio. Para ello se debe calcular la cantidad de moles de carbonato que se formó. Dominar estos problemas de estequiometría con disoluciones es un objetivo importante a lograr en el curso. A continuación, en la Figura 2, se muestra un planteo presentado:
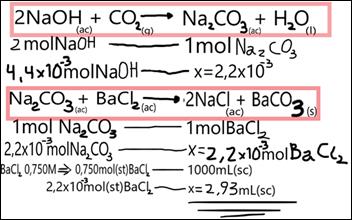
Figura 2: Respuesta de un estudiante a la pregunta 16.
La actividad 17 es una pregunta abierta que busca indagar si las y los estudiantes encuentran alguna otra observación sobre el diseño experimental, sobre aspectos químicos y biológicos u otro comentario sobre el artículo. Por ejemplo, una estudiante afirmó: “Yo creo que se debería tener la concentración del HCl inicial, además de que deberían estar correctamente expresados los errores de apreciación en las medidas para mayor comprensión, y las unidades deberían ser todas expuestas en unidades de molaridad dado que es la que se utiliza generalmente (universalidad).”
Respuestas a las preguntas de apreciación de esta actividad de integración entre biología y química
La mayoría afirmó que le gustó esta actividad de integración: “Si, estuvo interesante aplicar métodos químicos y biológicos para contestar las preguntas”, “Si, me pareció una actividad bastante integradora, donde se puede observar de qué manera la química se vincula fuertemente con la biología y cómo ésta influye mucho a la hora de los resultados”, “Sí, me parece que nos hace darnos cuenta de la estrecha relación entre la química y la biología”.
Pudieron vincular y/o aplicar los conceptos vistos en la teoría y práctica de Química General: “Sin duda, repase lo visto en el laboratorio 2 sobre titulación ácido-base. También usé la tabla de solubilidad y demás estrategias de cálculo”. A algunas/os no les resultó una actividad difícil: “No, me parece que hay que comprender lo que está sucediendo en la experimentación para poder interpretar todo correctamente”. Y en general destacan la utilidad de la actividad: “Sí, no solo por el hecho de aplicar y relacionar los conceptos que aprendí en ambas asignaturas, sino que también puedo aplicar dicho experimento a futuros trabajos empleándolo como una herramienta o un modelo inicial”, “Sí, porque pude repasar varios conceptos y fijar otros que no recordaba o no había entendido bien”, “Espero que haya más ejercicios porque para mí se me hizo más útil entender química, leyendo un trabajo en el que incluya la biología como este”, “Si me gusto esta tarea pero tal vez estaría mejor hacerla en un laboratorio”.
DISCUSIÓN
Muchas veces en biología se aplican temas de química que no han sido vistos en las asignaturas de química, dado que ambas ciencias siguen su lógica disciplinaria o su programa escolar. No es el caso de los temas comprendidos en esta experiencia descripta en este trabajo. El potencial de esta actividad yace en que las y los estudiantes cuentan con todos los conocimientos químicos necesarios para comprenderla y ejecutarla. La no integración entre ambas asignaturas constituye la pérdida de una oportunidad idónea para hacer resignificar las ciencias experimentales a las y los estudiantes.
Los resultados que se desprenden de las respuestas a la guía de preguntas muestran que las y los estudiantes pudieron resolver las cuestiones aplicando lo visto en química, ya sea en primera instancia o en una instancia de revisión. La discusión que sigue hace hincapié en el análisis del diseño experimental presentado en el artículo, que justifica la secuencia de preguntas de la guía y las respuestas esperadas de las y los estudiantes. Estas reflexiones son el principal aporte de este artículo.
Si bien en el artículo analizado se concibe a la propuesta como integradora de conceptos que permite que el alumnado perciba la utilidad de otras disciplinas, en su construcción no participaron docentes de la química que se está enseñando paralelamente. Unificar la terminología y la aplicación de procedimientos y conceptos químicos promueve beneficios en la enseñanza de ambas materias y, fundamentalmente, en el aprendizaje de las y los estudiantes. Con ello se brindaría una imagen distinta a la de disciplinas compartimentos estancos, percibiendo que se trata de ciencias naturales experimentales. Esto contribuiría verdaderamente al desarrollo de las actitudes científicas esperadas.
Aunque se mencionan algunos aspectos químicos que se expresan en forma inadecuada, no es el objetivo de esta presentación llevar adelante una revisión crítica del artículo de Tognetti, o del diseño experimental que presenta sino, por el contrario, resaltar su potencialidad como actividad de integración, de relación entre la química y la biología. Con esta intención es que se diseñó la guía de preguntas y actividades presentada a las y los estudiantes.
Respecto a contenidos y procedimientos aludidos en el artículo, además de la inapropiada forma de expresar algunas medidas, se aprecia un error en la afirmación: “Por ende, cada dos moles de HCl gastado en la titulación, equivalen a 1 mol de CO2 capturado” (Figura 3, página 25). Esta expresión es incorrecta, dado que los moles de HCl que se gastan corresponden al NaOH remanente, que no reaccionó con el CO2. En realidad, a lo que se refiere, en base al procedimiento que se detalla en otro párrafo, es a los moles de HCl correspondientes a la resta del volumen de HCl gastado en el blanco menos el gastado en cada tratamiento; con ese valor se obtendría el resultado correcto.
Siguiendo un enfoque químico, dado que se titula el NaOH remanente, lo que quedó de NaOH luego de que parte reaccionara con CO2, lo lógico sería calcular la diferencia entre la cantidad inicial en moles y la cantidad remanente, para hallar la cantidad de moles de NaOH que reaccionó con el CO2, para luego calcular por estequiometría cuántos moles de CO2 se atraparon. Preguntarse qué tengo en el erlenmeyer que voy a titular, cuántos moles de NaOH están presentes en 10,0 mL de disolución 1,00 M.
En este TP de Biología General orientado a la medición de CO2 producido en sistemas cerrados, se modificó una técnica propuesta originalmente en la bibliografía para la evaluación de la actividad respiratoria de suelos. Si bien todo el procedimiento no está desarrollado en el artículo, la resolución que propone permite translucir que se sigue la lógica de un algoritmo, de una técnica extraída de un texto, que resulta complicada (o inentendible) para el estudiantado que lo aplicará mecánicamente; en lugar de seguir un razonamiento lógico que se desprenda de conceptos químicos más directos y habilidades de resolución de problemas que se aprendieron en Química General, donde se ponen en juego conceptos básicos de estequiometría y titulación.
La resolución se plantea casi como una receta, en la que se ingresan datos y se obtienen resultados. Se pretende un enfoque de presentación de problema abierto y se ofrece una resolución cerrada. Con lo cual se desperdicia una valiosa oportunidad de llevar adelante un abordaje conceptual, que implicaría la aplicación sistemática de conceptos químicos a un problema químico. Por ejemplo, no se aclara, ni se problematiza, para qué se agrega cloruro de bario.
En el artículo se hace hincapié en incitar al estudiantado a realizar predicciones, sin embargo, no se realizan predicciones de tipo químico, por ejemplo, predecir cuántos moles de dióxido de carbono habría inicialmente en el recipiente. Con este valor se puede predecir el volumen de HCl que se gastará al titular el blanco. O predecir los volumen de HCl que se gastará suponiendo que el recipiente no contiene CO2 inicialmente (20,0 mL). Estos cálculos se podrían solicitar al estudiantado. Este cuestionamiento fue percibido por un estudiante que expresó: “Me resultó extraño que al trabajar con un gas en ningún momento usaran la ecuación del gas ideal.”
Si suponemos que en el aire hay 400 ppm de dióxido, o sea 0,04 %, y si el volumen total es 1,0 L, la temperatura 20,0°C, la presión atmosférica 1,0 atm, podemos hallar, mediante la ecuación de gases ideales, el número de moles total de gas, de aire (0,042 moles), y luego el número de moles de dióxido (0,04 %), se obtiene 1,7 x 10-5 moles de CO2. Luego se puede asumir que todo ese CO2 del recipiente (del blanco) fue atrapado por el NaOH (3,4 x 10-5 moles). El número de moles de NaOH remanente sería 0,010 -0,000034 = 0,009966 moles. Cálculo expresado en forma de que se aprecie que la cantidad de dióxido de carbono en un recipiente de un litro es despreciable. En definitiva, en la titulación del blanco se estaría titulando la disolución inicial de NaOH (10,0 mL, 1,00 M).
Se debe acentuar el hecho que la experiencia es válida en diseños de comparación cualitativa, como se muestran en la Tabla 2 del artículo analizado, este aspecto no se menciona en el texto. Esto se debe, presumiblemente, a que se asume como una técnica relativamente precisa, dado que no se percibe la necesidad de valorar previamente las disoluciones empleadas. Si se plantean diseños comparativos entre dos tratamientos; es decir, buscar conclusiones relativas, no haría falta titular previamente el HCl ni el NaOH, ni tampoco haría falta realizar un blanco.
Si bien es un objetivo loable presentar ejemplos de aplicaciones de contenidos químicos en biología, para consolidar el aprendizaje de esos conceptos, las reflexiones de este artículo van más allá al resaltar la importancia de ofrecer una visión unificada de las ciencias experimentales.
La desconexión entre las materias del mismo año de carrera, fomenta cierta desorientación en las y los estudiantes. Y, fundamentalmente, se desaprovecha una oportunidad de enseñanza y aprendizaje, que está “servida”, al no integrarse las dos disciplinas. Esto lleva a que se empleé un algoritmo (no entendido por el estudiantado) en lugar de procedimientos abordados de forma sistemática y teórica en Química General.
CONCLUSIONES
Los conceptos científicos tienen su complejidad intrínseca y no se aprenden en una sola instancia de enseñanza. Actividades de integración como la expuesta son útiles para la contextualización, aplicación y consolidación de conocimientos.
El diseño experimental presentado es interesante en sí mismo, dado que puede ser utilizado en clases de Química y de Biología, especialmente en carreras de ciencias naturales.
Se ha puesto en evidencia la necesidad de interrelación entre profesores de Biología y de Química. Una comunicación sobre acuerdos en los enfoques de presentación y resolución de situaciones químicas que se presentan en prácticos de laboratorio. Una articulación entre materias para el beneficio de la comprensión de las y los estudiantes. Para que puedan percibir la unidad de las ciencias experimentales y no compartimentar las mismas.
Es importante un cambio de concepción sobre los contenidos comunes, sobre los contenidos de las ciencias experimentales en general, que habría que individualizar y consensuar. Esto es válido también si se incluye alguna materia de Física. Especialmente lo referido a la medición, los errores de apreciación de los instrumentos, la selección adecuada de instrumentos, la expresión correcta de las medidas que trasluzcan el instrumento usado, el empleo de cifras significativas, el manejo de las mismas, al manejo de mezclas homogéneas de proporciones determinadas a través de unidades de concentración, la resolución de aspectos cuantitativos de reacciones químicas con reactivos en disoluciones, etc.
Un primer paso es tomar conciencia que estos conocimientos no son exclusivos de la química, que forman parte del bagaje de las ciencias experimentales como una unidad, que deberían abordarse en forma articulada, unificando enfoques y terminología.
En palabras de Mercé Izquierdo (2022): “Para poder hablar un mismo lenguaje con significado en las clases de Química y de Biología, la actividad científica escolar ha de ser, a la vez, química y biológica, según sean las situaciones a tratar y los objetivos de aprendizaje. El diálogo entre ambas disciplinas para generar el lenguaje adecuado para la ciencia escolar no solo es posible, sino que es imprescindible.”
REFERENCIAS BIBLIOGRÁFICAS
Bodner, G. y Orgill, M. (2007). Theoretical frameworks for research in chemistry and science education. Pearson Prentice Hall.
Izquierdo, M. (2022). Buscando un mismo lenguaje para enseñar mejor la Biología y la Química. Revista de Educación en Biología, 25(1), 79-91. https://revistas.unc.edu.ar/index.php/revistaadbia/article/view/36491
Prediger, S., Gravemeijer, K. y Confrey, J. (2015). Design research with a focus on learning processes: an overview on achievements and challenges. ZDM Mathematics Education, 47(6), 877–889. https://doi.org/10.1007/s11858-015-0722-3
Silverman, D. (2000). Doing Qualitative Research. Sage
Tognetti, C. (2009). Uso de una técnica sencilla de determinación de CO2 en primer año de la carrera universitaria de biología. Revista de Educación en Biología, 12(2), 22-26.